

有机硼化学已经成为有机化学研究的一个重要的前沿领域,其中sp3四配位硼中间体是有机硼试剂合成与应用的基础。虽然四配位硼的重要性已经得到普遍认可,但是有关四配位硼中间体的化学还有非常大的局限。鉴于四配位硼中间体在合成化学中有着举足轻重的地位,本课题组在过去的几年里以四配位硼化学中的主要挑战为研究对象,以绿色、高效的合成方法为策略,对四配位硼化合物的活化新模式、新型反应策略以及手性构筑及应用进行系统研究,发展了一系列新颖的基于四配位硼的非传统转化反应,主要集中在以下三个方面:1)C-B键的构建,为简捷、实用、高效合成有机硼化合物提供新方法、新策略;2)C-C键的构建,以构筑有机硼化合物为契机,突破有机硼化合物参与的偶联反应的瓶颈,拓展新的偶联模式(包括迁移反应),为有机硼转化注入新的活力、寻找更为宽广的出路;3)手性C-H键的构建,发现并发展了一类新型手性四配位硼,通过其活化水分子,产生一种强的布朗斯特酸,成功实现了目前没法完成的2-芳基以及2-大位阻烷基未保护吲哚的还原,为不对称合成提供了新的思路和策略。
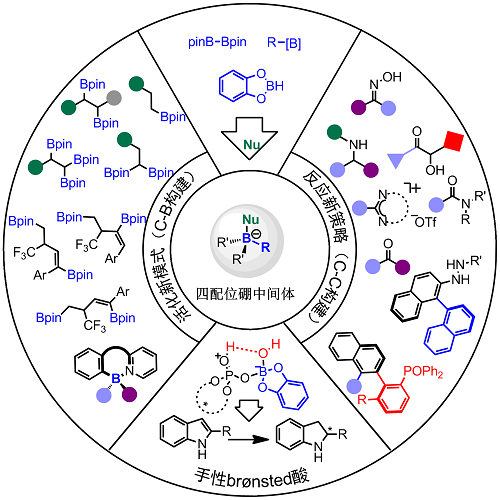
(一)C-B键构建
路易斯碱活化联硼化合物能形成四配位联硼活性中间体,该中间体能与过渡金属经转金属能得到高活性的金属硼物种或者发生还原消除反应。通过该反应性质,本课题组实现了铜催化b-CF3-1,3-烯炔的高区域、立体和化学选择性双硼化反应和手性钯不对称催化合成轴手性芳基硼化合物。
(1)铜催化b-CF3-1,3-烯炔的高区域、立体和化学选择性双硼化反应
具有三氟甲基的多硼化合物是合成各种重要分子的前体,本课题组以b-CF3-1,3-烯炔为底物,通过配体和碱的调控,实现了Cu-Bpin复合物对这类共轭体系的高化学、高区域和高立体选择性的加成,可以得到1,3-E-type,1,3-Z-type以及1,4-Z-type三种双硼产物 (Chem. 2020, 6, 2347)(图一)。
与蓝宇教授课题组合作,结合理论计算和控制实验,提出了可能的反应机理。在Cycle I 中,1,3-烯炔区域选择性地插入Cu-Bpin 物种Int-1的Cu-B键,得到物种Int-2(这一区域选择性受CF3影响),经1,3-Cu 迁移得到丙二烯基铜中间体Int-3。随后,中间体Int-3会有两种质子化途径。(1)在强碱(叔丁醇钠)作用下,中间体Int-3直接被甲醇质子化,得到高炔丙基硼酸酯2。随后2在活性Cu-Bpin 物种Int-1及膦配体作用下,区域选择性的进行第二次硼化(Cycle II):在大位阻膦配体(PCy3)作用下,区域选择性地得到Z-1,3-二硼化产物4;在小位阻膦配体(P(OEt)3)作用下,区域选择性地得到Z-1,4-二硼化产物5。(2)在弱碱(碳酸锂)作用下,中间体Int-3被路易斯酸(MeOH-Li2CO3)质子化,得到丙二烯丙基硼酸酯3,随后插入Cu-Bpin 物种Int-1的Cu-B键,得到烯丙基铜物种Int-6,再在碳酸锂的辅助下质子化得到E-1,3-二硼化产物6(Cycle III)
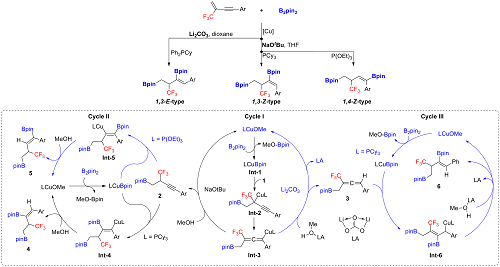
图一 β-CF3-1,3-烯炔双硼化反应
(2)不对称催化合成轴手性芳基硼化合物
轴手性骨架常见于手性配体或有机催化剂、天然产物、药物以及材料分子中,其合成也受到化学家们的持续关注。尽管有机硼化合物具有潜在的轴向手性,不对称催化合成C-B 轴手性化合物具有很大的挑战,究其原因可能在于长的Csp2-B键 (1.58Å) 所引起的低旋转势垒,而常见的联芳基化合物Csp2-Csp2 键的键长仅约1.46Å;因此对于以C-B键为主轴的轴手性化合物而言,增加反应底物位阻则会导致反应不易进行,而位阻小则易于消旋。本课题组通过合理的设计出非对称联硼试剂,利用不对称Miyaura硼化反应高效、高对映选择性地构建了轴手性芳基硼化合物,首次实现了不对称催化合成C-B 键轴手性化合物(J. Am. Chem. Soc. 2021, DOI: 10.1021/jacs.1c04345)(图二)。
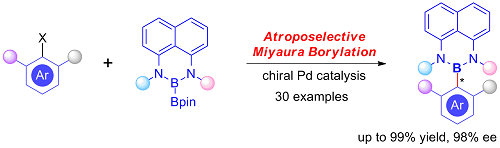
图二 不对称催化合成轴手性芳基硼化合物
(二) C-C键构建
(1)基于四配位中间体的远程1, n-迁移以及多重迁移反应构建C-C键
四配位硼中间体的迁移反应是有机硼化学中一个非常重要的过程。但是目前的迁移反应主要集中于1,2-迁移,对于远程1,n-迁移 (n³3, 即超过三个原子以上的迁移) 报道非常少。本课题组基于四配位硼中间体开发了1,3-双亲试剂的1,4-迁移反应、三组分1,3-双亲试剂的1,4-迁移反应以及1,1-双亲试剂的多重迁移。
1,3-双亲试剂的1,4-迁移反应。本课题组发展了腈氧化合物和硼酸原位生成四配位硼中间体经1,4-迁移反应合成立体化学纯的酮肟,在温和的条件下该策略表现出了优秀的立体选择性以及广泛的底物范围(Angew. Chem. Int. Ed. 2019, 58, 13421)。两种立体化学纯的不对称芳基酮肟以及热力学不稳定的Z-构型芳基烷基酮肟通过该策略都能以高立体选择性得到(图三)。
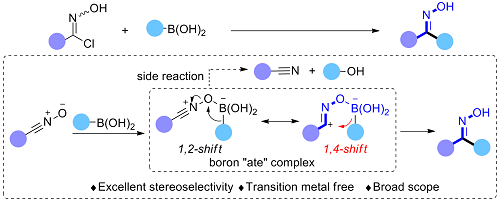
图三 立体专一性1,4-迁移反应立体汇聚合成立体化学纯的酮肟
三组分1,3-双亲试剂的1,4-迁移反应。随后本课题组开发了一种硼酸作为亲核试剂的Passerini型多组分反应(Nat. Commun. 2021, 12, 441),该反应在无过渡金属条件下,利用异腈化合物进攻醛类原位生成一种1,3-双亲试剂,其中的氧负离子与硼酸 (芳基,烯基硼酸和炔基三氟硼酸盐) 作用,生成四配位硼中间体,继而发生1,4-迁移反应水解后得到α-羟基酮类化合物(图四)。α-羟基酮(也称为酰基甘油)是天然产物和药物分子中普遍存在的结构模块,它们也是高价值转化和应用反应中常用的合成前体。该反应条件温和,易于操作,官能团兼容性好,具有广泛的底物范围和实用性。
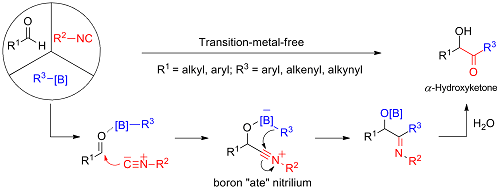
图四 硼酸参与的Passerini反应
1,1-双亲试剂的多重迁移反应。本课题组利用异腈化合物的1,1-双亲性质,使之与芳基硼酸通过先生成一个四配位硼中间体,然后发生1,2-迁移得到一个亚胺硼中间体,随后又通过生成四配位硼,连续的1,3-以及1,2-迁移实现了与异腈的两次插入偶联反应,简单、高效地合成了二芳基甲胺类化合物(图五)。该反应具有广泛的底物范围和良好的官能团耐受力,进一步的生物活性或药物分子修饰和配体合成证明了这种反应的实用性。与南方科技大学余沛源教授课题组合作通过DFT计算揭示了硼酸酐在这一转化过程中的重要作用,并为该反应提供了合理的机理解释。相关成果发表在Cell Rep. Phys. Sci. (2020, 1, 100268)上。
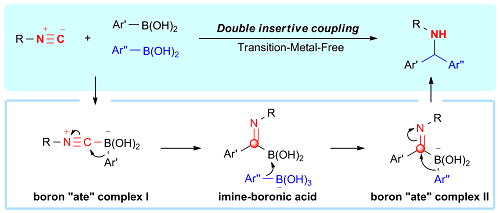
图五 基于四配位硼中间体的多重迁移反应
(2)钯催化硫脲或者硫代酰胺的Suzuki-Miyaura偶联反应
四配位硼中间体与过渡金属之间的转金属过程是金属催化的有机硼化合物构建C-C键的关键步骤。此外,过渡金属催化的卡宾交叉偶联反应为C-C键的构建提供了新的思路。2019年,本课题组开发了钯催化的硫脲或者硫代酰胺的Suzuki-Miyaura交叉偶联反应(Nat. Commun. 2019, 10, 5709)。通过该方法可以合成一系列的脒盐类化合物和酰胺类化合物(图六)。在合成应用上,该方法可以实现放大反应,也可以实现药物分子或天然产物的后修饰或合成。
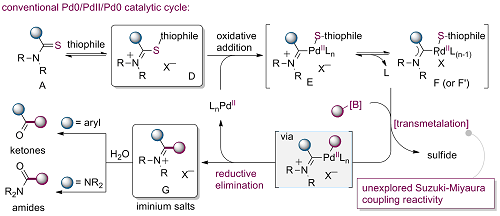
图六 钯催化硫脲或者硫代酰胺的Suzuki-Miyaura偶联反应
(三)手性四配位硼的设计及应用
手性四配位硼中间体在手性硼化合物的转化中起着必不可少的作用。此外,具有Lewis酸性的硼化合物能活化H2O形成强Brønsted酸(四配位硼),但类似的手性Brønsted酸尚未开发。2020年,本课题组巧妙地设计具有Lewis酸性质的手性磷酸硼活化水会原位产生一种新型的手性Brønsted酸(Angew. Chem. Int. Ed. 2020, 59, 3294)。与南方科技大学的余沛源课题组合作通过理论计算证实了该过程在热力学上可行的,同时发现新产生的Brønsted酸比TsOH酸性要更强。低温核磁也确认了一种新的Brønsted酸的产生。并将其成功应用于已知方法中难以实现的2-芳基以及大位阻烷基非保护吲哚的不对称还原。该还原体系有着良好的官能团兼容性,可以耐受氰基、硝基、三氟甲基等强吸电子基团,烯烃、炔烃、酯基等不饱和基团,以及卤素、Bpin和其他芳杂环。在克级反应中,其高对映选择性也得到了保持(图七)。
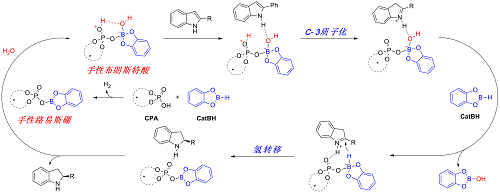
图七 手性四配位硼的设计及应用
地址:福建省厦门市集美区集美大道668号 邮箱:qsong@hqu.edu.cn 电话:0592-6162289 技术支持:企盟互联